May 25, 2019 Вид страницы:523
До сих пор не существует полностью идеального электролита для литиевых батарей. Наиболее часто используемые сегодня органические электролиты имеют высокую ионную проводимость и широкий диапазон температур. Разработка новых электролитов является обязательной, поскольку они легко воспламеняются и могут привести к несчастным случаям. Разработка новых электролитов требует надежной теории для поддержки, но поскольку электролит включает в себя более влияющие факторы (такие как вязкость, концентрация соли, растворение, ассоциация ионов и взаимодействие ионов с растворителем), механизм миграции ионов не очень ясен. Итак, как ионы лития мигрируют в органических электролитах, твердых электролитах и ионных жидких электролитах?
Во-первых, органический электролит
Электролит действует как носитель внутри литиевой батареи, который обеспечивает транспортный путь для переноса ионов между положительными и отрицательными материалами. Если просто взять процесс зарядки в качестве примера, Li + удаляется из положительного активного материала, а концентрация Li + на поверхности частиц твердой фазы положительного электрода снижается, так что разница концентраций возникает между внутренней частью и поверхностью частица, так что Li + генерирует частицы, которые диффундируют изнутри наружу. В то же время Li +, образующийся в результате электрохимической реакции на поверхности частиц, попадает в электролит, и локальная концентрация области границы раздела в фазе раствора увеличивается, вызывая разницу в концентрации внутри фазы раствора, что приводит к диффузии и миграции. Li + изнутри наружу. В области отрицательного электрода, поскольку частицы отрицательного электрода электрохимически реагируют с Li + в электролите, Li + в фазе раствора расходуется, а концентрация Li + в фазе раствора снижается, что приводит к разнице в концентрации, что приводит к диффузии и миграции. Li + снаружи внутрь в фазе раствора.
В то же время на поверхности частиц отрицательного электрода происходит электрохимическая реакция, и Li + интеркалируется, вызывая разницу в концентрации внутри частиц, что вызывает диффузию Li + снаружи внутрь частиц. В сепараторе из-за разницы в концентрации, вызванной положительным и отрицательным электродами, Li + в этой области вызывает диффузию и миграцию от положительного электрода к отрицательному, и процесс разряда противоположен описанному выше процессу. Из описанного выше процесса видно, что нормальная и эффективная работа литиевой батареи в основном определяется миграцией ионов лития внутри батареи. Миграция ионов лития ограничена свойствами электролита, и на свойства электролита в основном влияют следующие факторы.
1. Растворение литиевой соли
Электролит состоит из растворенного вещества и растворителя. Растворенное вещество обычно выбирают из жидкости, состоящей из множества органических растворителей. Когда LiPF6 растворяется в растворителе, образуются ионы лития и отрицательные ионы PF6. Растворение литиевой соли тесно связано с диэлектрической проницаемостью растворителя, и чем больше диэлектрическая проницаемость, тем сильнее растворимость литиевой соли. Когда ионы лития полностью окружены молекулами растворителя, действие отрицательных ионов на ионы лития ослабляется, происходит так называемое растворение. Для солей лития, чем крупнее анион, тем лучше ионная проводимость электролита и его собственное растворение, потому что чем крупнее анион, тем легче рассеять его отрицательный заряд и предотвратить спаривание катионов.
2. Вязкость электролита.
Вязкость электролита оказывает важное влияние на движение ионов, и чем ниже вязкость, тем благоприятнее движение ионов.
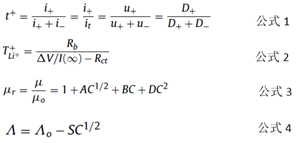
Ионы лития переносятся и переносятся под действием растворения и вязкости электродной жидкости. В формуле 1 t + - это количество переносов, i + и i- представляют ток, образованный катионом и анионом, соответственно, он представляет полный ток, u ± представляет подвижность аниона и катиона, а D ± представляет коэффициент диффузии аниона и катиона.
Фактически, ионное сопротивление связано не только с анионами и катионами, но и с растворителем. Число миграций ионов можно выразить уравнением 2:
Среди них TLi ++ представляет количество миграций ионов лития, Δ V - напряжение поляризации, I ( ∞ ) - ток в установившемся состоянии после поляризации, а Rb и Rct - объемное сопротивление и сопротивление переносу заряда.
Электролит однофазной системы растворителей трудно иметь одновременно высокую проводимость и низкую вязкость. Поэтому обычно используемый растворитель электролита состоит из множества растворителей, таких как бинарный электролит. (Литиевая соль) + (1-w) (растворитель A) + w (растворитель B), единица m литиевой соли обычно представляет собой молярную концентрацию, моль / кг, а w - массовая доля растворителя. Для единичных электролитов не существует надежной теории, позволяющей предсказать вязкость и ионную проводимость электролита. Джонс-Доул (JD) и Дебай-Хюккель-Онсагер (DHO) предложили две эмпирические формулы, уравнение 3 и уравнение 4:
Где μr - относительная вязкость, μ - вязкость раствора, μ0 - вязкость чистого растворителя, C - концентрация соли лития, A, B и D - коэффициенты, Λ - молярная проводимость, а Λ0 - молярная проводимость состояние бесконечного разбавления. S - параметр, на который влияют физические свойства растворителя и свойства электролита, а C - концентрация растворенного вещества. Эмпирическую формулу также необходимо модифицировать, если меняются типы солей лития и растворителей. Для смешанных электролитов формула более сложная.
Следовательно, когда конфигурируется новый многокомпонентный электролит, характеристики электролита необходимо тестировать для определения, и предварительная оценка не может быть выполнена. Хотя ионная проводимость имеет большое влияние на характеристики батареи, другие факторы, такие как образование и характеристики SEI, также являются очень важными факторами, и следует также учитывать стабильность, токсичность и т.п. электролита при большом увеличении. Короче говоря, перед рассмотрением параметров ионной проводимости следует учитывать все факторы, связанные с фактическим производственным применением.
Во-вторых, твердый электролит
По сравнению с жидкими органическими электролитами твердые электролиты имеют большие преимущества для литиевых батарей, такие как простая конструкция, удобная упаковка, хорошая устойчивость к ударам и вибрации, хорошая устойчивость к температуре и давлению, электрохимическая стабильность и широкий диапазон, а также безопасность. Хороший секс и тд. Однако ионная проводимость твердых электролитов относительно ограничена. В общем, твердые электролиты можно разделить на гелевые полимеры, полимеры без растворителей, неорганические кристаллические соединения, неорганические стеклянные материалы и тому подобное. Внутри неорганического кристаллического соединения проводимость ионов лития обусловлена миграцией подвижных ионов между благоприятными участками энергии окружающего потенциала, а движение окружающих ионов обеспечивает энергию активации для движущихся ионов, заставляя их проходить через каналы в кристаллической структуре.
Механизм переноса ионов полимерного электролита отличается от механизма неорганического кристаллического соединения и жидкого электролита. В полимерных электролитах без растворителей подвижность ионов зависит от движения полимерного материала-хозяина. Ионы перемещаются только тогда, когда сегмент полимера испытывает движение со значительной амплитудой, связанное с температурой стеклования (Tg). Полимерный электролит проявляет быструю ионную проводимость при температуре выше, чем температура стеклования Tg, и в этом случае полимерный электролит в основном состоит из аморфной фазы. Следовательно, полимер, имеющий низкую температуру стеклования Tg, такой как PEO (Tg-50 до -57 ° C), стал важным полимерным хозяином электролита без растворителя, и аморфизация полимера изучается как способ увеличения его ионной проводимость. . Полимерные электролиты гелевого типа обладают более высокой ионной проводимостью, чем электролиты без растворителей, из-за диффузии низкомолекулярных растворителей в полимере и движения полимерных сегментов.
На примере ПЭО механизм переноса электролита для этого типа полимера показан на рисунке выше. После электризации сегментарное движение аморфной части полимера приводит к повторяющемуся процессу «декомплексно-рекомбинации» Li +. Обеспечьте быструю миграцию.
Твердые электролиты на основе тонкопленочной технологии, разработанные в полупроводниковой промышленности, интенсивно изучаются в качестве ключевых компонентов твердотельных микробатареек. Стоимость большинства кристаллических и стеклообразных электролитов, разработанных для микробатарей, слишком высока из-за длительного времени синтеза и высоких температур в производственном процессе. Помимо этих недостатков, неорганические материалы для твердых электролитов обычно содержат дорогие металлы, такие как Ge, Ti, Sc, In, Lu, La и Y. Полимерные электролиты гелевого типа оказались коммерчески успешными из-за трудностей, возникающих при усилении и применении большинство твердых электролитов.
В-третьих, ионный жидкий электролит
Другой класс материалов, которые считаются электролитами, - это ионная жидкость. Определение ионной жидкости в настоящее время неясно, и обычно считается, что это жидкость, полностью состоящая из катионов и анионов, которая представляет собой жидкую органическую соль при комнатной температуре или близкой к комнатной температуре. Ионные жидкости обладают уникальными свойствами, включая негорючесть, низкое давление пара, высокую термическую стабильность, хорошую электрохимическую стабильность, низкую токсичность и высокое содержание ионов.
Как правило, ионные жидкости подразделяются на три типа: ионная жидкость типа AlCl 3, ионная жидкость не-AlCl 3 и специальная ионная жидкость. Физико-химические свойства различных ионных жидкостей можно найти в соответствующей литературе. В общем, вязкость ионной жидкости на один-два порядка выше, чем вязкость жидкого электролита, поэтому ионная проводимость на три-четыре порядка ниже, чем ионная проводимость жидкого электролита. Закон Вальдена обычно используется для установления связи между проводимостью и вязкостью ионных жидкостей, выражаемой следующим образом:
λi - ионная проводимость типа ионов i, а μ - вязкость.
Поскольку вязкость в значительной степени определяется взаимодействием таких влияний, как ван-дер-ваальсовы взаимодействия, конформационные степени свободы, кулоновские силы и формы ионов, исследователи приложили значительные усилия для изучения взаимодействия ионных веществ в ионных жидкостях. Помимо низкой ионной проводимости, ионные жидкие электролиты вряд ли образуют слои SEI на углеродных анодных материалах, что приводит к истощению циркулирующих ионов Li. Поэтому во многих случаях ионные жидкости требуют использования добавок в качестве электролитов.
Страница содержит содержимое машинного перевода.
 Оставить сообщение
Оставить сообщение



Мы скоро свяжемся с вами